Chemie
1. Chemická reakce
jako rovnovážný děj
Nejvíce probíraným (a asi nejdůležitějším) rovnovážným dějem na střední škole jsou chemické reakce.
Rozebereme si úplně typickou reakci vzniku jodovodíku: ![]() na mikroskopické úrovni a z pomocí matematiky a fyziky
odvodíme několik pravidel pro reakce. Aby reakce proběhla je nutné, aby se
setkala molekula vodíku a molekula jódu. Pravděpodobnost, že tyto molekuly
potkají je tím větší, čím větší je množství těchto molekul v místě reakce.
Množství molekul v roztoku běžně udáváme pomocí koncentrace. Rychlost
reakce (množství molekul HI, které přibudou za nějakou dobu), tedy odpovídá
koncentracím vodíku a jódu. Zbývá zjistit jak.
na mikroskopické úrovni a z pomocí matematiky a fyziky
odvodíme několik pravidel pro reakce. Aby reakce proběhla je nutné, aby se
setkala molekula vodíku a molekula jódu. Pravděpodobnost, že tyto molekuly
potkají je tím větší, čím větší je množství těchto molekul v místě reakce.
Množství molekul v roztoku běžně udáváme pomocí koncentrace. Rychlost
reakce (množství molekul HI, které přibudou za nějakou dobu), tedy odpovídá
koncentracím vodíku a jódu. Zbývá zjistit jak.
Představme si, že kontrolujeme srážky molekul v roztoku, desetiprocentní koncentrací jódu i vodíku (1 z deseti molekul je molekula vodíku a jedna je molekulou jódu, ostatní molekuly nás nezajímají, z nich jodovodík nevznikne). Potřebujeme zjistit jaká část srážek, jsou srážky vodík s jódem (při těchto srážkách může vzniknout jodovodík). Srážky jsou náhodné, představíme si, že budeme vybírat molekulu, která přiletí zprava a molekulu, která přijde z leva. Pravděpodobnost, že levá molekula bude vodík je stejná jako jeho koncentrace (0.1, když budu náhodně vybírat molekuly, průměrně každá desátá bude vodíková). Vidím, že z pravděpodobností rovnou 0.1 získám zleva molekulu vodíku. Abych se mohl pokusit vytvořit molekulu HI potřebuji, nyní zprava molekulu jódu. Ta přijde zase s pravděpodobností 0.1 (jenom jedna z deseti vybraných molekul zprava bude jódová). Pravděpodobnost, že získáme správnou srážku je tedy 0.01, součin koncentrací obou látek. (Můžeme k tomu dojít i takto. Máme sto srážek, z nich je jedna desetina takových, že levá molekula je vodík, takže celkem je těchto srážek deset. V této skupině zleva správných srážek, jsou ale různé pravé strany. Nás zajímají ty, které mají vpravo jód. Těch je jedna z deseti. Je-li tedy zleva správných reakcí deset a z nich je každá desátá správná zprava, máme pouze jednu ze sta správnou zleva i zprava).[1]
Předchozí odstavec je zcela klasickou ukázkou kombinatoriky, což je část matematiky, která by nám ušetřila dva odstavce.
Zapíšeme náš výsledek o rychlosti reakce: ![]() . Konstanta k je tam proto, že nemáme zaručeno, že každá
srážka vodíku s jódem skončí vznikem jodovodíku. Rychlost je pouze úměrná
součinu koncentrací reaktantů.
. Konstanta k je tam proto, že nemáme zaručeno, že každá
srážka vodíku s jódem skončí vznikem jodovodíku. Rychlost je pouze úměrná
součinu koncentrací reaktantů.
Zatím reakce vůbec nevypadá na rovnovážný děj. Což
spravíme hned. Řekli jsme si, že některé srážky vodíkové a jódové molekuly
skončí tím, že obě zaniknou a místo nich se objeví dvě molekuly jodovodíku. Co
však stane, když se v roztoku potkají dvě molekuly jodovodíku? Stejně jako
v případě molekul vodíku a jódu se může stát, že se molekuly srazí tak
nešťastně, že se rozpadnou a vzniknou
molekuly jiné (a to vodíku a jódu). Reakce se jakoby vrací zpět
(vznikají zase reaktanty, které byly na začátku), říkáme, že je vratná. Vidíme,
že teoreticky se může alespoň s mizivou pravděpodobností rozpadnout
jakákoliv molekula, která v při reakci vzniká.[2]
Naše reakce je vybraná tak, aby zpětný chod byl rozumně pravděpodobný. Jeho
pravděpodobnost bude zase úměrná pravděpodobnosti srážky dvou molekul – teď
jsou obě molekuly jodovodíkové. Rychlost zpětné reakce můžeme zapsat ![]()
Konečně tak získáme rovnovážný děj. Máme dvě reakce, první probíhá na začátku rychle (je hodně molekul vodíku a jódu), pak zpomaluje, (vodík a jód u bývá, jak z nich vzniká jodovodík), druhá na začátku skoro neprobíhá (není jodovodík), ale postupně se zrychluje (přibývá jodovodík). Normální reakce vyrábí zdroje pro zpětnou, zpětná pro normální. Čím víc bude jodovodíku, tím víc se ho bude rozpadat, čím víc se ho bude rozpadat, tím víc ho zase vznikne.
Jako každý rovnovážný děj i tento musí skončit v rovnováze, kdy se přestane měnit koncentrace jodovodíku, vodíku i jódu, ale ne tím, že by ustaly obě reakce, rovnováha nastane, když obě reakce budou probíhat stejně rychle (Počet jodovodíků, který normální vyrobí, zpětná zase rozbije), stejně jako když se voda vypařovala do uzavřené nádoby. Stav rovnováhy můžeme opět popsat pomocí našich rovnic:
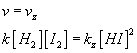
Po malé úpravě potom dostaneme 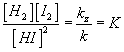 .
.
Konstantě K se říká konstanta rovnovážného stavu a dá se velice snadno určit změřením koncentrací reaktantů po ustálení reakce.
Zajímavé je, že konečný stav reakce se nebude záviset na to,
zda jsme na začátku ve zkumavce měli jenom vodík a jód nebo jenom jodovodík.
V prvním případě bude do nastolení rovnováhy probíhat více reakce ![]() (tedy z části vodíku a jódu vznikne jodovodík),
v druhém proběhne víc
(tedy z části vodíku a jódu vznikne jodovodík),
v druhém proběhne víc ![]() (část jodovodíku se
rozpadne na vodík a jód). Fakt, že konečný stav rovnovážných dějů nezávisí na
počátečních podmínkách, ale pouze na vlivech ovlivňujících rovnováhu, je
obecným pravidlem [3].
(část jodovodíku se
rozpadne na vodík a jód). Fakt, že konečný stav rovnovážných dějů nezávisí na
počátečních podmínkách, ale pouze na vlivech ovlivňujících rovnováhu, je
obecným pravidlem [3].
Vrátíme se
k našim rovnicím. Při určité teplotě nastává rovnováha naší reakce
při těchto koncentracích látek: ![]() ,
, ![]() a
a ![]() . Hodnota rovnovážné konstanty se dá snadno určit
. Hodnota rovnovážné konstanty se dá snadno určit 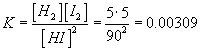 .
.
Ze spojení „při určité teplotě“ je jasné, že rovnovážná konstanta a tím i koncentrace látek budou na teplotě záviset. Zkusíme s malou pomocí fyziky a velkou pomocí termochemie vymyslet jak.
Rozpad jodovodíku je endotermní (spotřebovává energii). Vznik jodovodíku musí být exotermní (energii uvolňuje) – jinak bychom popřeli zákon zachování energie. Znamená to, že pokud se dva jodovodíky srazí, ale jejich energie bude malá (menší než je potřeba na rozpad a utvoření vodíku s jódem), reakce neproběhne. Pravděpodobnost rozpadu jodovodíku by se tedy zvětšila, kdyby na sebe jodovodíkové molekuly narážely větší rychlostí. Fyzika říká, že větší rychlost mají částice při větší teplotě. Je tedy jasné, že teplota bude rovnovážný stav ovlivňovat, a to v neprospěch jodovodíku (při vyšších teplotách bude rozpad jodovodíku rychlejší a proto ho v rovnovážném stavu bude méně, hodnota K se tedy zvětší.)
Zase se kousek vrátíme, tentokrát k našemu pravidlu, že konečný stav reakce je určen její rovnovážnou konstantou a ukážeme si, jak lze toto pravidlo neskutečně fikaně využít při výrobě mnoha chemických látek.
Už na základní škole se učí, že určitá skupina látek,
schopných ve vodě uvolňovat kationty ![]() se nazývá kyseliny
(patří sem kyselina sírová nebo citrónová). Různé kyseliny jsou při uvolňování
kationtů
se nazývá kyseliny
(patří sem kyselina sírová nebo citrónová). Různé kyseliny jsou při uvolňování
kationtů ![]() z vody různě
úspěšné (stejné množství různých kyselin uvolní ve vodě různé množství
kationtů) a právě tato jejich schopnost je mírou jejich síly (silnější kyselina
uvolní více
z vody různě
úspěšné (stejné množství různých kyselin uvolní ve vodě různé množství
kationtů) a právě tato jejich schopnost je mírou jejich síly (silnější kyselina
uvolní více ![]() ). Druhou základní reakcí, která je v souvislosti
s kyselinami zmiňována je jejich reakce s hydroxidy (látky, které
z vody uvolňují aniont
). Druhou základní reakcí, která je v souvislosti
s kyselinami zmiňována je jejich reakce s hydroxidy (látky, které
z vody uvolňují aniont ![]() ), při nichž vzniká sůl a voda (vodu známe a soli se souhrnně
nazývají látky vzniklé uvedenou reakcí). Příkladem takové reakce je vznik
kuchyňské soli, která vznikne reakcí kyseliny chlorovodíkové a hydroxidu
sodného (
), při nichž vzniká sůl a voda (vodu známe a soli se souhrnně
nazývají látky vzniklé uvedenou reakcí). Příkladem takové reakce je vznik
kuchyňské soli, která vznikne reakcí kyseliny chlorovodíkové a hydroxidu
sodného (![]() ). Kyselinu si můžeme představit jako poměrně nešťastný vztah
vodíku s dalším prvkem (nebo skupinou prvků), která sice vydrží
s vodíkem, ale ráda by ho vyměnila za něco lepšího (například Na). Jakmile
tu příležitost získá, snaží se jí využít. Síla kyseliny by pak odpovídala,
touze po nahrazení vodíku něčím lepším. Reakce s hydroxidem je pak obecně
naplněním tužeb každé kyseliny po výměně vodíku a sůl jejím šťastným naplněním.
). Kyselinu si můžeme představit jako poměrně nešťastný vztah
vodíku s dalším prvkem (nebo skupinou prvků), která sice vydrží
s vodíkem, ale ráda by ho vyměnila za něco lepšího (například Na). Jakmile
tu příležitost získá, snaží se jí využít. Síla kyseliny by pak odpovídala,
touze po nahrazení vodíku něčím lepším. Reakce s hydroxidem je pak obecně
naplněním tužeb každé kyseliny po výměně vodíku a sůl jejím šťastným naplněním.
Co se stane, když zkusíme reakci soli nějaké slabé kyseliny
se silnější kyselinou? Předchozí odstavec napovídá, že silnější kyselina bude
chtít připravit slabší o jejího společníka v soli a takto vypuzený zbytek
kyseliny se bude muset zase spokojit s vodíkem a vytvořit původní
kyselinu. Takový děj zachycuje následující rovnice: ![]() a umožňoval by vyrábět slabší kyselinu z její soli
pomocí kyseliny silnější. Při troše odvahy nám však tento vztah umožní vyrábět
(ač to zní nesmyslně) i silnější kyselinu z její soli pomocí kyseliny
slabší.
a umožňoval by vyrábět slabší kyselinu z její soli
pomocí kyseliny silnější. Při troše odvahy nám však tento vztah umožní vyrábět
(ač to zní nesmyslně) i silnější kyselinu z její soli pomocí kyseliny
slabší.
Vzpomeňme si, že jsme říkali, že všechny chemické děje
probíhají na obě strany. V našem případě to znamená, že v roztoku
probíhá i opačný děj ![]() . Rovnováha je však velice zřetelně posunuta ve prospěch
první rovnice a v okamžiku dosažení rovnovážného stavu je HCl v roztoku
jenom mizivé množství.
. Rovnováha je však velice zřetelně posunuta ve prospěch
první rovnice a v okamžiku dosažení rovnovážného stavu je HCl v roztoku
jenom mizivé množství.
Dále budeme postupovat na skutečném případě: ![]() je reakce, která
probíhá pouze velice málo. Častější je opačná reakce, (což znamená, že
je reakce, která
probíhá pouze velice málo. Častější je opačná reakce, (což znamená, že ![]() je silnější kyselina
než
je silnější kyselina
než ![]() ). Proto se tato reakce nedá samostatně použít na výrobu
kyseliny dusičné, protože by jí tak vzniklo jenom malé množství.
). Proto se tato reakce nedá samostatně použít na výrobu
kyseliny dusičné, protože by jí tak vzniklo jenom malé množství.
Stačí si však uvědomit naše předchozí pravidlo, že konečný
stav nezávisí na počátečních podmínkách, ale jen na rovnovážné konstantě
reakce. Abychom vyrobili větší množství ![]() , potřebujeme stejný stav jaký byl na počátku –tedy žádnou
, potřebujeme stejný stav jaký byl na počátku –tedy žádnou ![]() v roztoku. Kdybychom
dokázali tento úvodní stav navozovat, mohl bychom touto reakcí vyrábět i
v roztoku. Kdybychom
dokázali tento úvodní stav navozovat, mohl bychom touto reakcí vyrábět i ![]() . Proto jsme si vybrali tuto reakci. První reakce je vzácná,
ale přesto se k výrobě
. Proto jsme si vybrali tuto reakci. První reakce je vzácná,
ale přesto se k výrobě ![]() používá.
V průběhu reakce je
používá.
V průběhu reakce je ![]() jako látka
s nejnižší teplotou varu průběžně
odpařována a tak se neustále narušuje rovnováha. Reakce musí reagovat na
nedostatek
jako látka
s nejnižší teplotou varu průběžně
odpařována a tak se neustále narušuje rovnováha. Reakce musí reagovat na
nedostatek ![]() (vzhledem
k reakci). Jakmile odeberu
(vzhledem
k reakci). Jakmile odeberu ![]() rovnováha se naruší
a reakce musí vyprodukovat další
rovnováha se naruší
a reakce musí vyprodukovat další ![]() (aby bylo zachováno
pravidlo o rovnovážném stavu.) ta se zase odpaří a tak pořád dokud není
spotřebována všechna sůl.
(aby bylo zachováno
pravidlo o rovnovážném stavu.) ta se zase odpaří a tak pořád dokud není
spotřebována všechna sůl.
Tento postup „narušování“ rovnováhy je starý a používá se například k výrobě železa.
2. Chemie jako fyzika elektronového obalu a periodická
tabulka prvků
Největší souvislostí v chemie je periodická tabulka prvků, která je v dnešní době pokládána skoro za její základ. Tabulka sama je potom hotovým dolem na souvislosti.
Chemie se zabývá reakcemi mezi atomy a molekulami. Z fyzikálního hlediska se zabývá ději v elektronovém obalu prvků, přesněji pouze v jeho poslední (říká se valenční vrstvě“). Důvodem pro toto omezení je energie (změna ve valenční vrstvě atomu vyžaduje daleko méně energie než změna ve vnitřní vrstvě) a fakt, že elektrony z vnějších vrstev samovolně zaplňují díry v nižších vrstvách. Obrovský rozdíl mezi energií, kterou můžeme získat spálením uhlí a jadernou reakcí uranu, je právě v tom, že uhlí uvolňuje energii chemických vazeb (valenčních elektronů vzdálených od jádra a méně přitahovaných), zatímco při jaderné reakci se uvolňuje energie jádra, která drží pohromadě protony.
Nejdůležitější souvislost periodické tabulky je uspořádání prvků do sloupců (nazývají se skupiny). Prvky v jednotlivých sloupcích mají stejné chemické vlastnosti, právě proto, že mají stejný počet valenčních elektronů – tedy elektronů, které se mohou účastnit chemických reakcí. Z tohoto ihned plynou nejvyšší možná oxidační čísla (nebo násobnost vazeb) jednotlivých prvků – sodík je v prvním sloupci, má jeden valenční elektron a může být ve sloučeninách pouze maximálně s oxidačním číslem jedna, hliník je ve třetím sloupci, tedy tři elektrony ve valenční vrstvě a oxidační číslo maximálně 3, síra je v šestém sloupci a největší oxidační číslo má osm.
Základní tendencí prvků je mít valenční slupku zaplněnou.Proto se vzácné plyny, které mají úplnou valenční vrstvu (dva u hélia a osm u ostatních), nazývají netečné. Chemických reakcí se účastní jen velice málo, protože v nich nemají co získat, jejich valenční vrstva je ve stavu, po kterém touží každý atom. Halogenidům ze sedmého sloupce chybí ke spokojenosti jediný elektron a proto rády vstupují do reakcí, kde ho mohou získat (proto tvoří kyseliny, kde ho kradou vodíku, nebo soli, kde ho kradou jiným prvkům). Jejich touha po elektronu je tím větší, čím blíže k jádru se nachází valenční vrstva (bližší elektrony jsou více přitahovány jádrem) a proto jejich reaktivita klesá s rostoucím atomovým číslem (odshora dolů).
Opačným příkladem jsou alkalické kovy. Mají jediný valenční slabě vázaný elektron. Zaplnění valenční vrstvy elektronů dosáhnou snadněji tím, že jeden elektron ztratí a proto se účastní reakcí, kde mohou elektron ztratit (třeba reakce s halogenidy). Zajímavé je porovnat jejich reaktivitu. U halogenidů reaktivita s atomovou hmotností klesala (zachycovaný elektron byl méně přitahován). U alkalických kovů se s rostoucí atomovou hmotností zmenšuje síla, kterou je přitahován valenční elektron a tak je stále snazší se ho zbavit. Proto reaktivita alkalických kovů s rostoucí atomovou hmotností roste.
Předchozí fyzikální úvaha o síle, kterou jsou přitahovány elektrony k jádru, vysvětluje i úhlopříčné uspořádání prvků, které tvoří kyseliny a zásady. Spojíme v periodické tabulce levý horní a pravý dolní roh a tato linie rozdělí tabulku na dvě poloviny. Prvky v horní pravé polovině tvoří kyseliny a to tím silnější čím dále jsou od rozdělovací linie, prvky pod linií tvoří hydroxidy (a opět nejsilnější jsou ty, co jsou od linie nejdále). Prvky na linie nebo v její blízkosti mohou tvořit i zásady i kyseliny. Stačí, abychom si uvědomili, že kyselé skupiny se snaží získat elektrony (jedná se tedy o prvky, kterým chybí jenom málo elektronů a jejichž valenční elektrony jsou silně přitahovány), zatímco hydroxidy elektrony zahazují (protože jich mají ve valenční vrstvě málo nebo už jsou příliš daleko od jádra).
Souvislosti mohou fungovat i zpětně. Celá chemie je jedním z nejlepších potvrzení fyzikální teorie atomového obalu a krásně nám vypovídá o počtech elektronů v jednotlivých vrstvách.
?? Otázky
Ø Zkus sestavit co nejkompletnější teorii atomového obalu (typy vrstev, kolik mají elektronů) založenou na vysvětlení chemických zákonitostí. Porovnej z učebnicí fyziky.
Ø Co znamená chemický fakt velice podobných chemických vlastností a lanthanoidů aktinoidů pro umístění odpovídajících elektronových vrstev v elektronovém obalu?
?? Otázky na souvislosti chemie
Ø Proč nehoří voda?